
长远目标,是将猪胎儿的肾脏移植给患有波特综合征的人类胎儿。
日本科学家团队近日进行了一次特殊的器官移植实验,把一只大鼠胎儿的肾组织移植给了另一只大鼠胎儿。
尽管距离临床应用仍有距离。但国内母胎医学专家指出,这次实验成功令人兴奋,意味着宫内治疗的疾病谱有望进一步拓展。
本次实验还发现,受体胎儿的血管在移植肾脏内生长,有国外专家指出,这意味着克服了移植后的免疫排斥问题。研究者本人表示,目前他正在进行猪到猴的宫内移植实验,长远目标是将猪胎儿的肾脏移植给人类胎儿。
绿色发光的肾脏
成功完成上述实验的是东京慈惠会医科大学肾脏病学家Takashi Yokoo的团队,研究成果发表在预印本平台bioRxiv上。《自然》网站报道称,这是首次子宫内的器官和组织移植。
促使这些科学家挑战宫内器官移植的,是一种名为波特综合征(Potter Syndrome)的罕见疾病,胎儿肾脏完全缺失或严重畸形(发育不良),从而导致孕期羊水量减少,而羊水对胎儿肺器官发育至关重要,肺得不到充分发育,婴儿出生时或出生后不久就会死亡。
波特综合征目前仍无法治愈。由于可以通过产前诊断发现,医生通常会建议波特综合征患儿的母亲提前终止妊娠。而如果能在宫内就进行肾移植,让胎儿拥有功能健全的双肾,就可以避免之后的一系列连锁反应,挽救胎儿的生命。带着这个想法,Takashi Yokoo和同事行动起来。
用于移植的肾组织非常微小,为了便于追踪,Takashi Yokoo团队首先对大鼠进行了基因修饰,让它们的肾脏表达一种绿色荧光蛋白。随后,他们将绿色的肾组织从大鼠胎儿体内提取出来,用一根细针将其插入仅18天大、还在母亲子宫内的几只大鼠胎儿背部皮下。共有来自4只大鼠母亲的9个胎儿接受了移植手术,其中8个胎儿长出了绿色发光的肾脏。Takashi Yokoo解释称,肾脏组织可能未在移植失败的那个胎儿中定植。
大约22天大(大鼠的正常孕期)时,接受移植的几只大鼠幼崽顺利出生。出生后,它们皮下的肾组织渐渐发育,形成了废物过滤单位(即肾小球)和层次分明的肾脏外部与内部结构。两周半以后,这些肾脏开始产生尿液。Takashi Yokoo表示,他们原本预计,这些肾脏的发育时间线和正常发育几乎相同。但由于移植的肾脏没有和输尿管相连,尿液无处可去,研究者不断对肾脏进行引流,直到这些大鼠在五个月大左右时被处以安乐死。
实验成功意味着什么?
“这次大鼠实验的成功令人兴奋,意味着宫内治疗的疾病谱有望进一步拓展。”上海市第一妇婴保健院胎儿医学科主任、产前诊断中心执行主任孙路明告诉“医学界”。
孙路明长期从事母胎医学的临床诊疗与研究,是国内最早规范开展宫内治疗的胎儿医学专家之一,也是中国首位在北美完成母胎医学临床规培的医生,并在国内率先建立与国际接轨的胎儿医学中心。
她告诉“医学界”,早年宫内手术是开放性的,对孕产妇的创伤比较大。近年来,随着胎儿镜等介入技术发展,宫内治疗大多数以微创方式进行,治疗范围也进一步拓展,目前在我国已开展的胎儿宫内手术包括胎儿镜下胎盘血管电凝术治疗双胎输血综合征、胎儿镜下严重先天性膈疝介入手术、胎儿先天性心脏病的宫内介入手术、各种选择性减胎技术等。
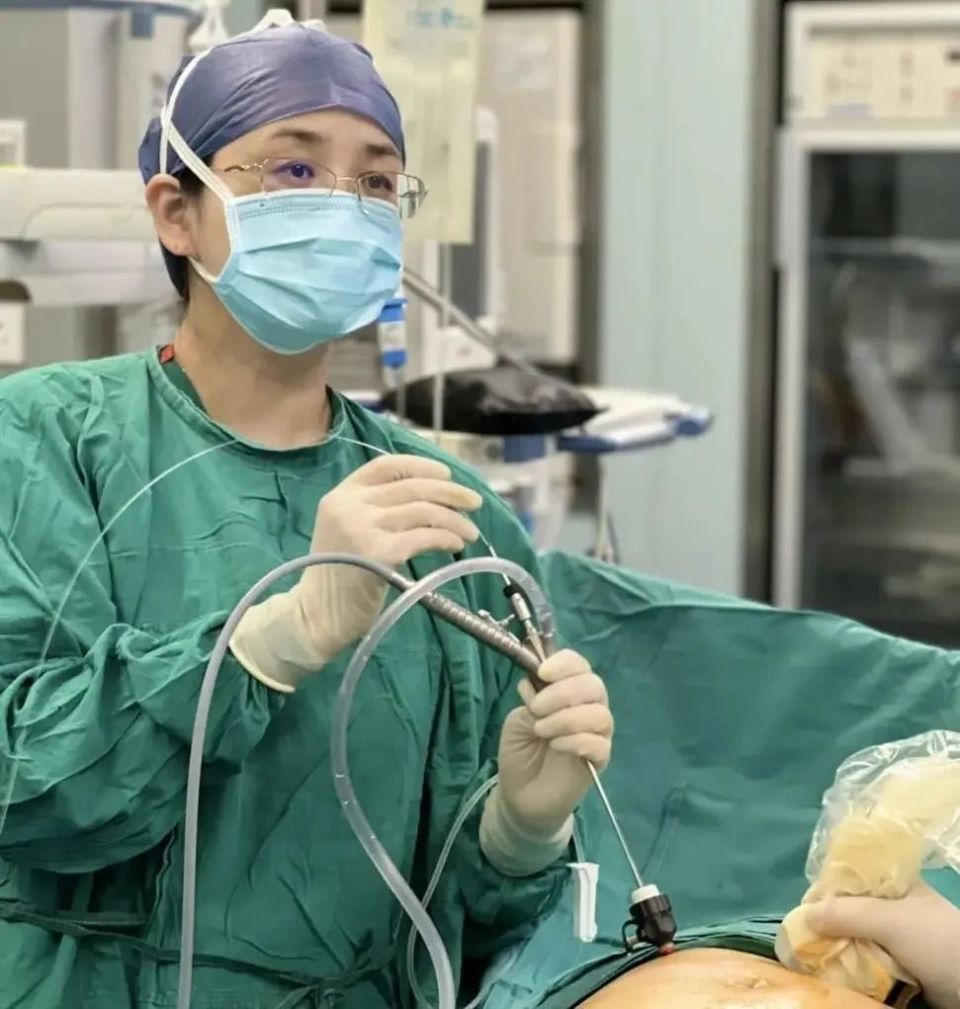
孙路明教授进行微创宫内手术
孙路明介绍,宫内手术对指征有严格把握,需要基于准确的产前诊断、有精确的分期或严重程度的分级、熟悉胎儿疾病的自然病程、动物模型证实手术确为可行,且目前确无有效的产后治疗方法。上述宫内肾移植致力解决的波特综合征属于这一类疾病。
不过,她也特别强调,对于宫内肾移植这样的突破性、探索性技术,未来若要应用于临床,手术必须在胎儿医学中心进行,多学科参与,需要经过充分的伦理讨论,告知家属宫内手术可能带来的母胎风险。
“宫内治疗的目的不仅仅是提高患病胎儿出生后存活率,更强调确保产妇的安全和健康,注重降低患儿的发病率和改善儿童的远期预后。如果患儿通过宫内手术存活下来,但长期的生活质量不好,仍会给患儿本人及其家庭带来沉重、长久的负担。”孙路明说。
孙路明认为,未来宫内治疗的范围还有望拓展到先天性遗传罕见病的基因及干细胞治疗,例如已有基因疗法的脊髓性肌萎缩(SMA)、成骨不全症(俗称“脆骨病”),以及酶替代疗法治疗溶酶体贮积症等内分泌遗传代谢病。随着新的诊断及治疗技术快速发展,越来越多的先天性疾病未来有望在宫内得到救治,以提高患儿的存活率及远期生命质量。
但孙路明指出,宫内治疗在国内虽然已经过十多年发展,但仍属于新兴技术,开展时要遵循“规范先行,制度先行,培训先行”。随着宫内治疗覆盖的疾病范围越来越广,更需要新生儿科、小儿内外科、遗传科等各专业的医生参与,形成多学科诊疗团队。
“如果要在临床上开展宫内肾移植,无疑需要更多学科的专家参与前期研究。”孙路明说。
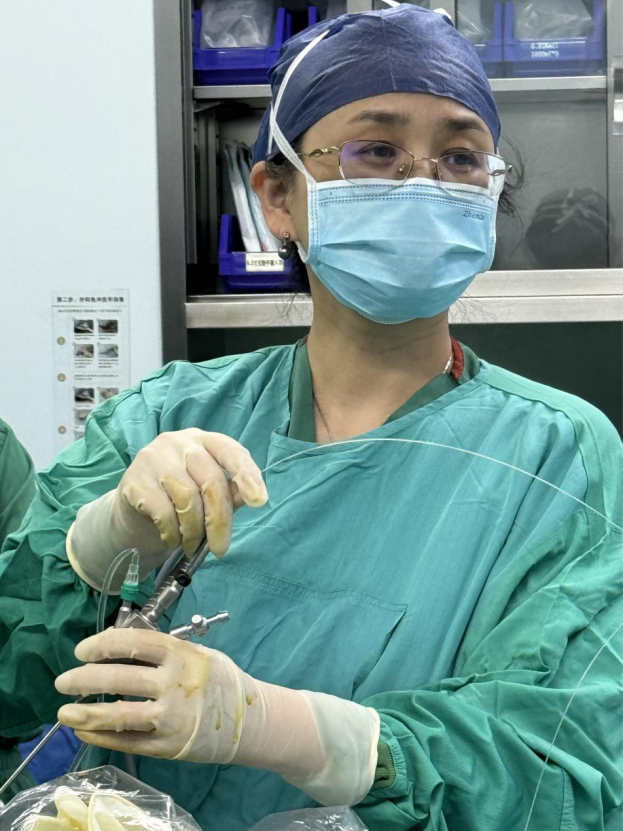
孙路明教授为患者手术中
有望解决异种器官移植排异难题?
“器官移植排异的一大原因就是供体血管和受体血管不相容,在本案例中,受体正在‘渗透进’移植的器官,你们克服了这一难题。这真的非常棒。”澳大利亚玛塔母亲医院(Mater Mothers’ Hospital)的胎儿外科专家Glenn Gardener对本次实验点评道。
近距离观察可以看到,胎儿的血管在供体组织内部生长,意味着这些肾脏被免疫系统排斥的可能性减小。Takashi Yokoo表示,他的长远目标是将猪胎儿的肾脏移植给波特综合征患儿。
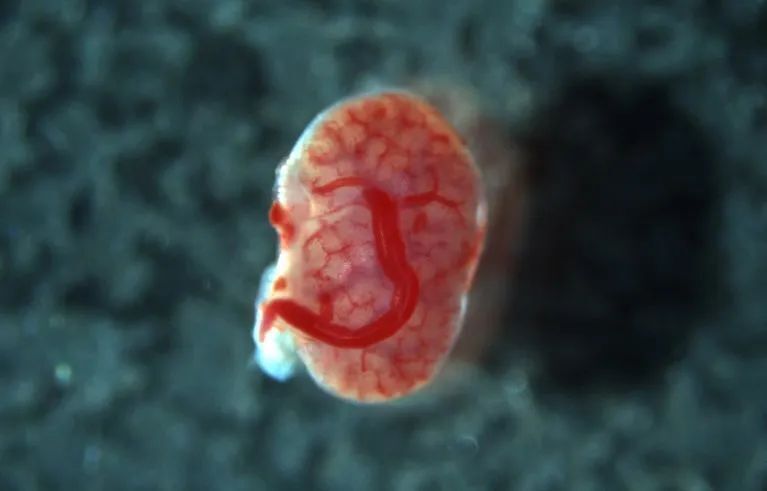
受体血管“渗透进”移植肾脏
为了测试异种器官移植的可能性,Takashi Yokoo还将小鼠的肾组织移植进大鼠胎儿体内,在4只大鼠身上获得了成功。肾脏在移植后的10天内不断发育,而且没有受到排斥。移植第18天时,肾组织出现了排异迹象,但排异可以通过免疫抑制剂缓解。
Takashi Yokoo表示,他还对11只猪的38个猪胎儿进行了猪对猪的宫内移植,18只猪崽顺利出生,但研究成果尚未发表。目前,他正在狨猴身上进行猪到猴的宫内移植实验,并且计划在几个月内开始对食蟹猴进行实验。
近年来,科学家多次尝试异种器官移植,已成功实施全球首例猪心、猪肝、猪肾人体移植手术。全球首例猪器官人体移植手术的纪录诞生于2022年1月,美国马里兰大学医学中心为一名57岁的终末期心衰患者移植了一颗猪心。这颗猪心经过了基因编辑,目的是使其适应人体,减少排异反应。然而,患者仍在术后两个月后死亡。根据研究团队后来发布于《柳叶刀》《新英格兰医学杂志》的分析报告,可能的死因之一就是排异反应。
本次实验成功后,Takashi Yokoo称,胎儿时期的组织产生免疫反应的可能性低于成人组织,意味着不需要在移植前进行基因修饰就可以杜绝免疫排斥。
不过,Glenn Gardener、约翰斯·霍普金斯大学胎儿介入专家Ahmet Baschat等专家均指出,虽然大鼠实验的结果令人震撼,是一个很棒的概念,但距离应用于人类仍有遥远的距离。
Takashi Yokoo则表示,他已经开始和公众交涉,告诉他们人类胎儿异种移植的优势,尝试获得他们的信任。他还计划向所在大学和医院的伦理委员会,以及日本的监管机构申请开展人体研究。

